
Back قانون بويل Arabic Llei de Boyle-Mariotte AST Boyl-Mariott qanunu Azerbaijani Закон Бойля-Марыёта Byelorussian Закон на Бойл – Мариот Bulgarian বয়েলের সূত্র Bengali/Bangla Llei de Boyle Catalan یاسای بۆیڵ CKB Boyleův–Mariottův zákon Czech Бойль — Мариотт саккунĕ CV
Ovaj članak ili neki od njegovih odlomaka nije dovoljno potkrijepljen izvorima (literatura, veb-sajtovi ili drugi izvori). |
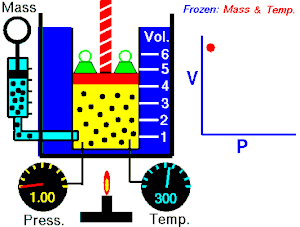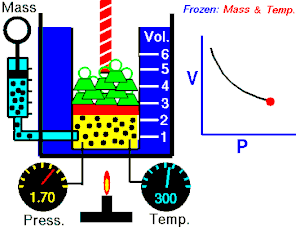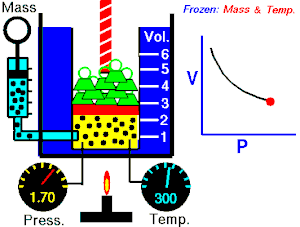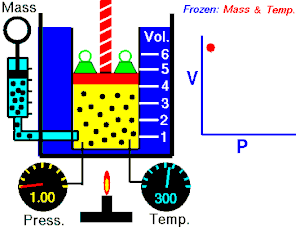
Boyle-Mariotteov zakon (poznat i kao Boyleov zakon[1]) je eksperimentalni plinski zakon koji opisuje kako pritisak plina teži povećanju pri smanjenju zapremine plina. Savremena formulacija Boyleovog zakona je
Apsolutni pritisak koji vrši određena masa idealnog plina je inverzno proporcionalna zapremini koju gas okupira ako su temperatura i količina gasa nepromijenjene unutar zatvorenog sistema.[2]
Matematički, Boyleov zakon se može izraziti kao
ili
gdje je P pritisak gasa, V je zapremina gasa, i k je konstanta.
Ova jednačina također definiše proizvod pritiska i volumena kao konstantu za određenu masu zatvorenog gasa dok god je temperatura konstantna. Radi upoređivanja iste tvari pod dva različita skupa uvjeta, zakon se može izraziti kao
Prethodna jednačina pokazuje da usljed povećanja zapremine, pritisak gasa se proporcionalno smanjuje. Slično, kad se volumen smanjuje, pritisak gasa se proporcionalno povećava.
Zakon je dobio ime po fizičaru Robertu Boyleu, zaslužnom za otkrivanje i objavljivanje originalnog zakona u 1662.
- ^ Draper, John William (1861). A textbook on Chemistry. str. 46.
- ^ Levine, Ira N. (1978). Physical Chemistry. University of Brooklyn: McGraw Hill. ISBN 978-0072538625.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search


